In tempi recenti, l’immunoterapia ha rivoluzionato i metodi di trattamento del cancro. Le strategie che ricorrono al sistema immunitario per la lotta contro i tumori sono diventate meno tossiche, più specifiche e più efficaci dei trattamenti tradizionali, come la chemioterapia e la radioterapia. Oggi, il trattamento con cellule CAR-T è una delle opzioni terapeutiche più promettenti e rappresenta una soluzione particolarmente innovativa per combattere le malattie complesse come il cancro.
Le cellule CAR-T vengono prodotte a partire dai linfociti T, che sono parte integrante del nostro sistema immunitario. I linfociti T possono venire sia da un donatore sano, sia dall’organismo del paziente stesso; si parla in quest'ultimo caso di terapie “autologhe”: la Food and Drug Administration (FDA, l’agenzia statunitense che si occupa della regolamentazione dei settori alimentare e farmaceutico) ha già approvato l’autorizzazione all’immissione in commercio di due prodotti di questo tipo. Se invece provengono da un donatore sano si parla di terapie “allogeniche”, attualmente in fase di sviluppo preclinico e clinico. Per svolgere il loro ruolo anticancro, le cellule devono essere “equipaggiate” con un recettore antigenico chimerico (detto CAR, che sta per Chimeric Antigen Receptor) che consente di rilevare e uccidere meglio le cellule tumorali. Questa modifica viene effettuata all’interno di laboratori specializzati in cui viene alterato il codice genetico dei linfociti T viventi per renderli capaci di esprimere (ovvero produrre) i CAR. Le cellule CAR-T sono ora pronte per essere nuovamente iniettate nell’organismo del paziente e iniziare a combattere il cancro.
Si può dire che le cellule CAR-T rappresentino una rivoluzione che trasformerà per sempre i metodi di trattamento del cancro? Nonostante lo sviluppo di queste cellule sia in piena espansione, restano ancora da superare molti ostacoli per poter utilizzare efficacemente queste terapie in tutto il mondo. Le attuali tecnologie hanno, di fatto, alcuni limiti, come l’alto costo di produzione e le difficoltà logistiche, soprattutto per quanto riguarda le terapie autologhe disponibili. In queste condizioni, i trattamenti con cellule CAR-T allogeniche o “pronte all’uso” costituiscono una soluzione più accessibile e vantaggiosa?
Un po’ di storia e di scienza
Il cuore del sistema immunitario è rappresentato dai linfociti T, la cui missione è quella di uccidere le cellule infette, tumorali o danneggiate[1] .
Accade, sfortunatamente, che le cellule tumorali riescano a mimetizzarsi: il sistema immunitario non le individua, perciò i meccanismi di difesa innati non sono più efficaci. Gli scienziati hanno quindi avuto l’idea di perfezionare i linfociti T affinché siano in grado di rintracciare e distruggere più efficacemente queste cellule. Sono stati messi a punto dei linfociti T con un’arma integrata nel codice genetico: i recettori antigenici chimerici (CAR). I CAR sono progettati per svolgere una doppia funzione: legarsi a biomarcatori specifici (antigeni) sulle cellule tumorali e attivare i meccanismi che annientano il cancro.
“……fino al 90% dei pazienti con leucemia ha riscontrato una remissione completa e duratura.”
Sono stati necessari decine di anni di ricerche di laboratorio per trasformare questa innovativa idea in un trattamento efficace per il paziente: il concetto di fondo, che consiste nell’estrarre le cellule immunitarie del paziente e modificarle per migliorarne le capacità antitumorali, è stato descritto per la prima volta 30 anni fa[2] . Successivamente, nel 2015, la tecnologia delle CAR-T ha riscosso un grande successo: nell’ambito di diverse sperimentazioni cliniche, fino al 90% dei pazienti con leucemia ha riscontrato una remissione completa e duratura[3] [4] . Da allora, il numero di lavori di ricerca e di studi clinici su questo tipo di terapie è aumentato esponenzialmente: a fine maggio si contava già un totale di 293 sperimentazioni sulle CAR-T attive in tutto il mondo[5] , rispetto alle 152 del 2017[6] . Nel 2018, due di queste terapie sono state approvate per il trattamento della leucemia e del linfoma negli Stati Uniti e in Europa: Yescarta, di Gilead Sciences, e Kymriah, di Novartis (recentemente approvata anche in Giappone e divenuta quindi l’unica terapia a base di cellule CAR-T disponibile in Asia)[7] . Questi due trattamenti richiedono l’utilizzo delle cellule dei pazienti per la produzione della terapia.
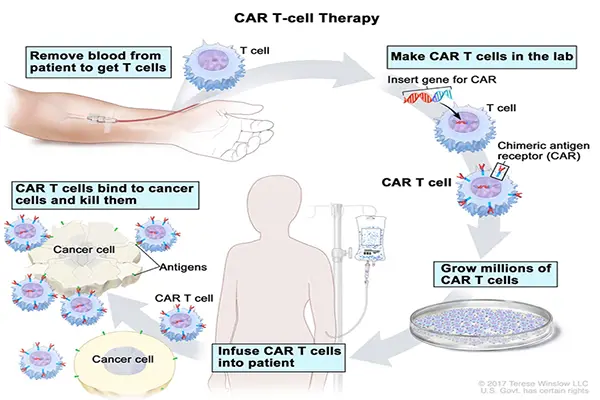
IL TRATTAMENTO CON CELLULE CAR-T (https://www.cancer.gov/types/leukemia/patient/child-all-treatment-pdq)/
Le cellule CAR-T vengono prodotte inserendo un gene nei linfociti T. Questo gene consente di codificare il recettore antigenico chimerico, ovvero il CAR (una proteina di sintesi di dimensioni ridotte che la cellula continuerà a produrre per rivestire la propria superficie). La funzione dei CAR è legarsi a un biomarcatore specifico (un antigene) presente sulla cellula tumorale. Una volta legatasi all’antigene tumorale, la cellula CAR-T viene attivata dalla porzione del CAR che si estende all’interno del linfocita T e mette in moto i meccanismi che annientano il cancro.
Una produzione delicata, una logistica complessa
Il processo di produzione di questo trattamento personalizzato comporta la necessità di raccogliere i globuli bianchi del paziente, estrarne i linfociti T, inviarli a un sito di produzione specializzato in cui vengono equipaggiati con i CAR, coltivare i linfociti T così modificati per ottenere una dose terapeutica sufficiente, quindi inviare nuovamente il prodotto preparato alla struttura ospedaliera che lo somministrerà al paziente. Complessivamente, questa procedura richiede tre settimane e due complessi cicli logistici che non interrompano la catena del freddo. Per garantire la massima sopravvivenza delle cellule, occorre conservarle congelate. Per garantire che vengano somministrate al paziente corretto, è anche tassativamente necessario preservare le informazioni sull’identità della persona da cui provengono[8] . Inoltre, il tempo a disposizione è poco: occorre tenere conto del fatto che questa terapia viene utilizzata principalmente su pazienti che hanno già avuto ricadute dopo altri trattamenti. Può quindi capitare di non poter procedere in quella che viene detta “finestra terapeutica” a causa del rapido avanzamento della malattia. D’altro canto, in alcuni casi, lo stato del paziente (e quello dei suoi linfociti T) non sono tali da consentire la produzione del trattamento. Per esempio, nelle sperimentazioni cliniche condotte prima dell’approvazione di Yescarta, uno dei 111 pazienti coinvolti non ha ricevuto il prodotto a causa di un problema relativo al processo di produzione. Altri nove pazienti non sono stati trattati a causa del progresso della malattia o di gravi complicanze rilevate dopo la raccolta delle loro cellule[9] . In generale, sul piano logistico la produzione di cellule CAR-T è complessa, richiede tempo e risulta costosa. Inoltre, è difficile controllare la qualità del prodotto finale: ogni paziente è diverso e lo stesso vale per i suoi linfociti T e le cellule CAR-T prodotte a partire da essi. I pazienti che forniscono il materiale di base per quanto riguarda le terapie autologhe hanno una storia medica diversa e variegata, differenti stadi della malattia e diversi patrimoni genetici. Tutti questi fattori contribuiscono alle complicanze che si incontrano a monte del processo di produzione. Questo metodo è quindi considerevolmente diverso da un processo di produzione convenzionale e ben definito.
“Nel caso di un prodotto che proviene dai pazienti stessi e dipende così da tanti fattori, è difficile giustificare un modello tradizionale per il calcolo del costo.”
La barriera economica
Nel caso di un prodotto che proviene dai pazienti stessi e dipende così da tanti fattori, è difficile giustificare un modello tradizionale per il calcolo del costo, basato su ricerca e sviluppo, produzione e logistica. Si potrebbe adottare invece un modello basato sui risultati: il prezzo del farmaco dipenderebbe dai vantaggi forniti anziché dai costi di sviluppo e produzione. Tuttavia, ricorrere a questo sistema di determinazione del prezzo di vendita per dei farmaci salvavita può avere dei risvolti pericolosi: le cellule CAR-T vengono spesso utilizzate come ultima risorsa, il che equivarrebbe quasi a dare un prezzo alla vita umana[10] . Per il momento, gli investimenti intrapresi dalle compagnie farmaceutiche sono considerevoli: dal 2012, Novartis ha speso oltre un miliardo di dollari per l’immissione in commercio di Kymriah mentre Gilead ha acquistato Kite Pharma, che ha sviluppato Yescarta, per quasi 12 miliardi di dollari. Inoltre, nonostante Novartis avesse inizialmente ipotizzato di fatturare il costo totale di Kymriah solo ai pazienti che avrebbero reagito alla terapia durante il primo mese di trattamento, l’idea è stata successivamente abbandonata[11] . Yescarta e Kymriah costano rispettivamente 373.000 dollari e 475.000 dollari a paziente. Nel 2018, le vendite di Yescarta sono salite a 264 milioni di dollari e nel primo trimestre del 2019 sono state prodotte ricette per 96 milioni di dollari, una cifra leggermente al di sotto dei 105 milioni di dollari attesi. Per quanto riguarda Kymriah, le vendite hanno raggiunto i 76 milioni di dollari nel 2018 e i 45 milioni di dollari nel primo trimestre del 2019[12] . A causa dei costi elevati, le autorità incaricate dell’approvazione e le compagnie di assicurazione si mostrano reticenti nei confronti di queste due terapie. Tutti gli sforzi per la riduzione del costo di fabbricazione avranno quindi un impatto positivo sull’accessibilità delle terapie con cellule CAR-T.
I donatori sani: una soluzione...
Si potrebbe risolvere la maggior parte dei problemi esaminati in precedenza con le terapie allogeniche che, invece di utilizzare le cellule dei pazienti, ricorrono alle cellule di donatori sani non consanguinei. Il fatto che le cellule dei donatori sani siano più facilmente reperibili consente di prelevare esclusivamente i linfociti T perfettamente adattati alla lotta ai tumori, cosa impossibile se il prodotto terapeutico venisse prodotto a partire dal paziente e le cellule in grado di combattere per la sua sopravvivenza sono quindi rare. D’altro canto, contrariamente a quanto avviene per le terapie CAR-T con approccio autologo, il risultato delle quali è affidato a una sola dose di trattamento, le cellule CAR-T pronte all’uso potrebbero offrire maggiore flessibilità grazie alla possibilità di dosaggi ripetuti. Inoltre, l’utilizzo di cellule provenienti da donatori sani potrebbe migliorare la qualità e l’innocuità del prodotto finale. Infine, il costo elevato della logistica a temperatura controllata, spesso attraverso diversi continenti, potrebbe, teoricamente, essere ridotto alla metà: occorrerebbe infatti trasportare una sola volta le cellule prelevate ai donatori ed equipaggiate con i CAR, per portarle dal sito di produzione alla struttura ospedaliera. Se si arrivasse a mettere in piedi un processo di produzione e consegna più redditizio, è evidente che i prezzi scenderebbero, le compagnie di assicurazione si mostrerebbero più disposte a rimborsare queste terapie e i pazienti potrebbero accedervi più facilmente.
...che comporta nuove sfide
Se il trattamento del cancro con cellule provenienti da donatori sani offre ottime prospettive per quanto concerne la sopravvivenza dei pazienti, presenta anche considerevoli rischi e non mancano i dubbi in merito. In primo luogo, questa procedura assomiglia a quella del trapianto, come il trapianto di cellule staminali del midollo osseo, in cui donatore e ricevente devono essere parzialmente compatibili per evitare qualsiasi reazione del trapianto verso l’ospite (GVH). Questo problema si verifica quando si iniettano cellule CAR-T non compatibili che non attaccano solo il cancro ma anche tutte le altre cellule dell’organismo ospite (il paziente). Contemporaneamente, può accadere che il sistema immunitario del paziente attacchi le cellule estranee e le uccida prima che possano distruggere il cancro. In tal caso si parla di rigetto del trapianto da parte dell’ospite (HVG). Esistono diversi metodi per risolvere questi problemi. Per esempio, si possono cercare donatori e riceventi compatibili[13] . Purtroppo, a causa dell’estrema sproporzione tra pazienti e potenziali donatori, questa strategia richiederebbe troppo tempo per avere un’utilità pratica. I ricercatori hanno quindi trovato il modo di aggirare questo ostacolo. Come detto in precedenza, la tappa più importante della produzione di cellule CAR-T per trattamenti sia autologhi, sia allogenici, consiste nell’aggiunta sulla superficie delle cellule di una proteina chimerica che si lega al tumore. Le cellule di un donatore terzo richiedono ulteriori modifiche che possono essere effettuate con tecniche di editing genetico[14] . Per esempio, per accertarsi che le cellule del donatore siano innocue per il paziente ed evitare casi di GVH, è possibile rimuovere dalla superficie delle cellule una molecola chiamata TCR (che sta per T-cell receptor, recettore delle cellule T). Inoltre, per evitare l’HVG, occorre rendere le cellule estranee non rilevabili da parte del sistema immunitario del paziente. A questo scopo, è possibile adottare diverse strategie, come la riduzione del tasso di proteina β2M. Non è certo semplice effettuare questa serie di modifiche, ma, grazie agli sforzi di numerosi ricercatori, tutto ciò è già possibile.
Il panorama concorrenziale e una fine d’anno che si prospetta ricca di novità
Malgrado tutte queste nuove sfide, i trattamenti con cellule CAR-T pronte all’uso sono in fase di sviluppo in tutto il mondo e il crescente interesse per le terapie prodotte utilizzando cellule di donatori si riflette già nelle statistiche delle aziende che si occupano di logistica a temperatura controllata, come Cryoport, uno dei leader nel campo della logistica di materiali sensibili alla temperatura come i farmaci fabbricati a partire da cellule vive. Nel primo trimestre del 2019, oltre il 30% dei servizi dell’azienda sono stati prestati nell’ambito delle sperimentazioni cliniche di terapie allogeniche.
“Malgrado tutte queste nuove sfide, i trattamenti con cellule CAR-T pronte all’uso sono in fase di sviluppo.”
Condotta da Cellectis, la prima sperimentazione clinica su questo tipo di trattamenti per la leucemia acuta linfoblastica recidivante/refrattaria ha dato risultati limitati. Si tratta, senza dubbio, di risultati molto incoraggianti, dal momento che la maggior parte dei pazienti ha reagito positivamente alla terapia, tuttavia due pazienti sono deceduti a causa della tossicità terapeutica[15] .
Il programma di Cellectis sui trattamenti con cellule CAR-T allogeniche e la gamma di farmaci attivi per la terapia cellulare preclinica di Pfizer sono in corso di sviluppo da parte di Allogene, in collaborazione con Servier. Allogene è stata fondata da due ex dirigenti di Kite Pharma che hanno lasciato Gilead. L’anno prossimo, l’azienda dovrebbe pubblicare un rapporto con i primi risultati del suo trattamento per la leucemia acuta linfoblastica. La sperimentazione clinica sul linfoma non-Hodgkin recidivante/refrattario è invece appena iniziata. Cellectis contribuisce anche allo sviluppo di altri tre prodotti candidati come trattamenti con cellule CAR-T allogeniche, attualmente in fase di sperimentazione clinica: ognuno di essi è mirato a un diverso tipo di cancro grazie all’utilizzo di antigeni tumorali specifici. Un aggiornamento sui dati significativi è previsto per la fine dell’anno. Nel novembre del 2018, invece, Celyad ha annunciato di aver iniettato al primo paziente il proprio prodotto terapeutico per il trattamento del tumore metastatico del colon-retto non operabile, alloSHRINK CYAD-101. Il CYAD-101 è nato da una precedente collaborazione tra Celyad e l’azienda giapponese ONO Pharmaceutical, che oggi lavora insieme a Fate Therapeutics allo sviluppo di due nuove terapie cellulari pronte all’uso. Il progetto preclinico di Fate si distingue significativamente da tutti gli altri trattamenti che utilizzano cellule CAR-T, poiché si basa su cellule staminali pluripotenti indotte anziché su cellule provenienti da donatori. Inoltre, il potenziale farmaco allogenico di Precision Biosciences per il trattamento del linfoma non-Hodgkin recidivante/refrattario e della leucemia acuta linfoblastica di tipo B è entrato nella fase di sperimentazione clinica nel mese di aprile. I primi risultati sono attesi alla fine del 2019 o all’inizio del 2020. CRISP Therapeutics AG, un’azienda di editing genetico, lancerà quest’anno alcune sperimentazioni cliniche nell’ambito del proprio programma CTX110 CD19 allo-CAR-T. Anche la sua concorrente Editas Medicine lavora allo sviluppo di trattamenti cellulari allogenici per la lotta ai tumori e Gilead ha avviato una collaborazione con Sangamo per sviluppare KITE-037, un progetto destinato a entrare nella fase di sperimentazione clinica nel 2020. Infine, ATARA Biosciences, che attualmente si dedica all’immunoterapia allogenica con linfociti T per combattere le infezioni virali e i tumori dovuti alle infezioni virali, ha lanciato quattro progetti CAR-T nell’ambito della sua pipeline preclinica.
“La quantità di innovazioni in materia di immunoterapia è in costante aumento, di pari passo con l’impegno delle aziende del settore sanitario per la lotta ai tumori.”
La quantità di innovazioni in materia di immunoterapia è in costante aumento, di pari passo con l’impegno delle aziende del settore sanitario per la lotta ai tumori. Attualmente, circa 140 società in tutto il mondo hanno almeno un programma terapeutico basato sulle cellule CAR-T[16] . Analogamente, molte imprese lavorano nello specifico sulle cellule CAR-T pronte all’uso in laboratorio e nell’ambito di sperimentazioni cliniche. Candriam ha l’ambizione di sostenere gli sviluppi più promettenti. Osserva scrupolosamente questo settore e segue da vicino i progressi della tecnologia. Questa analisi minuziosa implica ovviamente la necessità di valutare rigorosamente le tecnologie più all’avanguardia e dedurne il potenziale impatto sull’andamento delle azioni delle società che le sviluppano. La strategia di investimento Oncology di Candriam punta quindi a sostenere le aziende più dinamiche.
[1] https://www.nature.com/subjects/cytotoxic-t-cells
[2] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC298636/
[3] http://embomolmed.embopress.org/content/early/2017/07/31/emmm.201607485.long#DC4
[4] https://www.ncbi.nlm.nih.gov/pubmed/25317870?dopt=Abstract
[5] https://clinicaltrials.gov
[6] https://celltrials.org/public-cells-data/all-car-t-trials-cumulative-through-end-2017/56
[7] https://www.novartis.com/news/media-releases/kymriahr-tisagenlecleucel-first-class-car-t-therapy-from-novartis-receives-second-fda-approval-treat-appropriate-rr-patients-large-b-cell-lymphoma
[8] https://www.biopharmadive.com/news/car-t-supply-chain-cell-therapy-challenges-pharma/521560/
[9] https://www.yescarta.com/files/yescarta-pi.pdf
[10] https://www.europeancancerleagues.org/wp-content/uploads/2018/06/CAR-T-ECL-Article_Final_20062018.pdf
[11] https://cancerworld.net/cutting-edge/the-car-t-cell-revolution-what-does-it-offer-and-can-we-afford-it/
[12] https://www.evaluate.com/vantage/articles/news/corporate-strategy/novartis-hopes-kymriah-acceleration-can-save-its-car
[13] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5088751/
[14] https://www.ncbi.nlm.nih.gov/pubmed/30735463
[15] https://servier.com/wp-content/uploads/2018/12/PR_Servier-Allogene_ASH2018.pdf
[16] Lezione intitolata “Driving CARs in Aggressive Lymphoma” (L’evoluzione dei trattamenti con cellule CAR-T per il linfoma aggressivo) presentata all’assemblea annuale 2019 dell’ASCO, tenutasi dal 31 maggio al 4 giugno 2019
