Immunotherapie brengt sinds kort een revolutie teweeg in de behandelingsmethoden van kanker. Het immuunsysteem gebruiken om tumoren te bestrijden is minder toxisch, gerichter en doeltreffender dan traditionele behandelingen zoals chemotherapie en radiotherapie. Momenteel is een behandeling met CAR-T-cellen een van de meest veelbelovende behandelingsopties, een bijzonder innovatieve oplossing in de strijd tegen complexe ziekten zoals kanker.
Voor de aanmaak van CAR-T-cellen wordt uitgegaan van T-lymfocyten, die een essentieel onderdeel van ons immuunsysteem vormen. T-lymfocyten zijn ofwel herkomstig uit het lichaam van de patiënt zelf, dan spreken we van "autologe" therapieën. De Food & Drug Administration of FDA, die de commercialisering van geneesmiddelen in de Verenigde Staten goedkeurt, heeft al twee producten goedgekeurd. Ofwel zijn ze herkomstig van een gezonde donor en dan spreken we van "allogene" therapieën. Die bevinden zich momenteel in de preklinische en klinische ontwikkelingsfase. Om hun kankerbestrijdende rol te vervullen, moeten de cellen worden "uitgerust" met een chimerische antigeenreceptor (CAR) om kankercellen beter te kunnen detecteren en doden. Deze modificatie vindt plaats in gespecialiseerde laboratoria, waar de genetische code voor levende T-lymfocyten wordt gegenereerd om CAR's tot expressie te brengen. De CAR-T-cellen zijn dan klaar om terug in het lichaam van de patiënt te worden geïnjecteerd om de strijd met kanker aan te gaan.
Mogen we stellen dat CAR-T-cellen een revolutie zijn die een blijvende transformatie in de behandelingsmethoden voor kanker zullen teweegbrengen? Hoewel volop in ontwikkeling, zijn er nog tal van obstakels te overwinnen om deze therapieën wereldwijd effectief te kunnen ontplooien. De bestaande technologieën hebben hun beperkingen, zoals hoge productiekosten en logistieke moeilijkheden, met name de beschikbare autologe therapieën. Bieden allogene of "gebruiksklare" CAR-T-celbehandelingen gezien de omstandigheden dan een beter toegankelijke en meer rendabele oplossing?
Een stukje geschiedenis en wetenschap
Binnen het immuunsysteem is het de taak van de T-lymfocyten om geïnfecteerde, beschadigde of kankercellen te doden[1] .
Helaas slagen kankercellen er soms in zich te camoufleren: het immuunsysteem merkt ze niet op, waardoor de aangeboren bewakingsmechanismen het laten afweten. Dit bracht wetenschappers op het idee om T-lymfocyten te optimaliseren om die in staat te stellen deze cellen effectiever op te sporen en te vernietigen. Ze hebben T-lymfocyten ontwikkeld die voorzien zijn van een genetisch gecodeerd wapen: chimerische antigeenreceptoren (CAR's). CAR's zijn ontworpen om een dubbele functie te vervullen: specifieke biomarkers (antigenen) aan kankercellen bevestigen en kankerdodende mechanismen activeren.
“….in verschillende klinische proeven zag tot 90% van de leukemiepatiënten een volledige en blijvende remissie”
Het heeft enkele decennia aan laboratoriumonderzoek gevergd om dit innovatieve idee om te zetten in een effectieve behandeling bij de patiënt: een samenhangend concept van externe modificatie van immuuncellen van patiënten om hun kankerbestrijdende eigenschappen te verbeteren werd 30 jaar geleden voor het eerst beschreven[2] . En dan, in 2015, kende de CAR-T-technologie een groot succes: in verschillende klinische proeven zag tot 90% van de leukemiepatiënten een volledige en blijvende remissie[3] [4] . Sindsdien is het aantal onderzoeken en klinische studies voor dit soort therapie exponentieel toegenomen: eind mei waren er wereldwijd in totaal 293 actieve proeven op CAR-T's geregistreerd[5], tegenover 152 in 2017[6]. In 2018 werden twee van deze therapieën goedgekeurd voor de behandeling van leukemie en lymfoom in de Verenigde Staten en Europa: Yescarta, van Gilead Sciences, en Kymriah, van Novartis (onlangs ook goedgekeurd in Japan en daarmee de enige CAR-T-celtherapie die in Azië beschikbaar is)[7]. Bij de beide behandelingen worden cellen van patiënten gebruikt om het therapeutische product aan te maken.
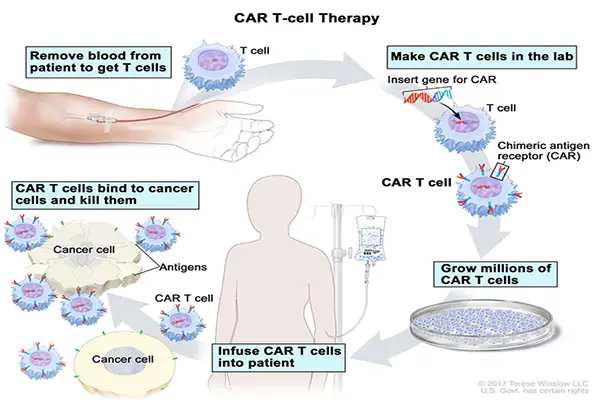
BEHANDELING MET CAR-T-CELLEN (https://www.cancer.gov/types/leukemia/patient/child-all-treatment-pdq)/
CAR-T-cellen worden gemaakt door een gen in de T-lymfocyt in te brengen. Met dit gen kan de chimerische antigeenreceptor worden gecodeerd: CAR (een klein synthetisch eiwit dat nu door de cel zal worden aangemaakt om het oppervlak te bekleden). De functie van de CAR's bestaat erin een specifieke biomarker (een antigeen) aan de kankercel te bevestigen. Eens deze aan het kankerantigeen bevestigd, wordt de CAR-T-cel geactiveerd door het deel van de CAR dat de T-lymfocyt binnendringt en brengt ze de kankerdodende mechanismen op gang.
Delicate productie, complexe logistiek
Het productieproces voor deze gepersonaliseerde behandeling bestaat uit het verzamelen van witte bloedcellen van de patiënt, het extraheren van de T-lymfocyten, ze naar een gespecialiseerde productielocatie sturen waar ze van CAR's worden voorzien, het kweken van de aldus gemodificeerde T-lymfocyten om een toereikende therapeutische dosis te verkrijgen en het bereide product vervolgens terug naar het ziekenhuis sturen voor toediening aan de patiënt. In totaal duurt dit een drietal weken en vergt dit twee complexe koellogistiekcycli. Om een maximale overlevingsgraad van de cellen te verkrijgen, moeten ze bevroren worden gehouden. Om te garanderen dat ze aan de juiste patiënt worden toegediend, is ook de instandhouding van de identiteitsketen een absolute noodzaak[8]. Daarnaast tikt de klok: vergeet niet dat deze therapie voornamelijk wordt toegepast op patiënten die na andere behandelingen al zijn hervallen. Dan bestaat de kans dat we niet kunnen overgaan naar een zogenaamd 'therapeutisch venster' doordat de ziekte snel voortschrijdt. Bovendien laat de toestand van de patiënt (en die van zijn of haar lymfocyten) in sommige gevallen geen productie voor behandeling toe. In klinische proeven die vóór de goedkeuring van Yescarta werden uitgevoerd, ontving één van de 111 patiënten bijvoorbeeld geen product door een defect in het productieproces. Negen andere patiënten werden niet behandeld wegens het ziekteverloop of ernstige complicaties nadat hun cellen waren verzameld[9] . Op logistiek vlak is de productie van CAR-T-cellen door de band een complexe, tijdrovende en dure zaak. De kwaliteit van het eindproduct is bovendien moeilijk te controleren: elke patiënt is anders, net als hun T-lymfocyten en de daarvan afgeleide CAR-T-cellen. Patiënten die in het kader van autologe therapieën het basismateriaal leveren, hebben diverse en uiteenlopende medische voorgeschiedenissen, verschillende ziektestadia en een verschillend genetisch erfgoed. Al deze factoren dragen bij tot de complicaties die vóór het productieproces optreden. Deze methode verschilt dus duidelijk van een welomschreven standaard productieproces.
“Bij een product dat van de patiënten zelf komt en van zo veel variabelen afhankelijk is, valt een traditioneel prijszettingsmodel waarin ook onderzoek en ontwikkeling, productie en logistiek zijn meegerekend, moeilijk te rechtvaardigen.”
Het kostenobstakel
Bij een product dat van de patiënten zelf komt en van zo veel variabelen afhankelijk is, valt een traditioneel prijszettingsmodel waarin ook onderzoek en ontwikkeling, productie en logistiek zijn meegerekend, moeilijk te rechtvaardigen. Men zou een resultaatgebonden model kunnen hanteren: de prijs van het geneesmiddel zou dan veeleer afhangen van de verkregen baat dan van de kosten voor ontwikkeling en productie. Dit prijszettingssysteem hanteren voor essentiële medicijnen kan echter een gevaar inhouden: CAR-T-cellen worden vaak als ultiem redmiddel gebruikt, zodat het haast zou neerkomen op het schatten van de prijs van een mensenleven[10] . De farmaceutische bedrijven investeren echter fors: Novartis heeft sinds 2012 meer dan een miljard dollar uitgegeven om Kymriah op de markt te brengen, en Gilead heeft bijna 12 miljard dollar neergeteld voor de overname van Kite Pharma, dat Yescarta heeft ontwikkeld. Hoewel Novartis aanvankelijk had aangegeven dat alleen patiënten die in de eerste behandelingsmaand een reactie zagen op de therapie de volle prijs van Kymriah zouden moeten betalen, heeft het dat idee inmiddels laten varen[11] . Yescarta en Kymriah kosten respectievelijk 373.000 dollar en 475.000 dollar per patiënt. In 2018 bedroeg de omzet voor Yescarta 264 miljoen dollar en bracht het middel 96 miljoen dollar inkomsten op in het eerste kwartaal van 2019, iets onder de consensus van 105 miljoen dollar. Voor Kymriah bedroeg de omzet 76 miljoen in 2018 en 45 miljoen dollar in het eerste kwartaal van 2019[12] . Vanwege hun hoge prijs stellen erkennende overheden en verzekeringsmaatschappijen zich tegenover deze twee therapieën enigszins terughoudend op. Zodoende zal elke inspanning om de productiekosten te verlagen gunstig zijn om CAR-T-celtherapieën toegankelijker te maken.
Gezonde donoren, een oplossing...
De voornoemde problemen zijn grotendeels op te lossen met allogene therapieën, waarbij wordt gewerkt met cellen van gezonde, niet-verwante donoren in plaats van cellen van patiënten. Omdat cellen van gezonde donoren makkelijker verkrijgbaar zijn, is het mogelijk om uitsluitend T-lymfocyten te verzamelen die perfect geschikt zijn om kanker te bestrijden, wat onmogelijk is als het therapeutische product van de patiënt komt en het aantal cellen dat in staat is om voor de overleving te strijden gering is. In tegenstelling tot bij de autologe CAR-T-methode, waarbij de therapeutische uitkomst afhangt van één enkele behandelingsdosis, kunnen gebruiksklare CAR-T-cellen de flexibiliteit van herhaalde doseringen aanbieden. Het gebruik van donorcellen kan ook de kwaliteit en veiligheid van het eindproduct verbeteren. Tot slot kan ook de hoge kostprijs van de koellogistiek, vaak met transport naar verschillende continenten, in theorie worden gehalveerd, vermits van donoren afgeleide cellen die van CAR's zijn voorzien slechts eenmaal, van de productielocatie naar het ziekenhuis, moeten worden vervoerd. Zouden we erin slagen een beter renderend productie- en leveringsproces op te zetten, dan zullen de prijzen natuurlijk dalen, zullen verzekeringsmaatschappijen eerder bereid zijn deze therapieën te vergoeden en zullen deze therapieën ook vlotter toegankelijk zijn voor patiënten.
... maar ook nieuwe uitdagingen
Hoewel de behandeling van kanker met cellen van gezonde donoren goede overlevingsvooruitzichten voor de patiënten biedt, zijn er aanzienlijke risico's aan verbonden en blijven er heel wat vraagtekens rond hangen. Ten eerste lijkt deze procedure op die van een transplantatie, zoals een beenmergstamceltransplantatie, waarbij donor en ontvanger perfect compatibel moeten zijn om alle mogelijke graft-versus-hostziekteverschijnselen (GVHD) te vermijden. Deze ziekte treedt op wanneer niet-compatibele CAR T-cellen werden geïnjecteerd en die niet alleen de kanker, maar ook alle andere cellen in het lichaam van de gastheer of "host" (de patiënt) aanvallen. Anderzijds valt het immuunsysteem van de patiënt soms vreemde cellen aan en doodt het deze voordat ze de kans krijgen om de kanker te vernietigen. Dit wordt de graft-versus-hostziekte genoemd (HVG). Er zijn verschillende methoden om deze problemen te verhelpen. Men kan bijvoorbeeld op zoek gaan naar een compatibele donor en ontvanger[13]. Wegens de grote verschillen tussen patiënten en potentiële donoren, lijkt deze strategie jammer genoeg echter te tijdrovend om enig praktisch nut te kunnen hebben. Wetenschappers hebben dan ook een manier ontdekt om deze hindernis te omzeilen. Hierboven stelden we al dat de voornaamste stap bij de productie van CAR-T-cellen bij zowel autologe als allogene behandelingen bestaat uit de toevoeging van een chimerische proteïne die zich aan het oppervlak van de kankercel vasthecht. Cellen van een derde donor vereisen bijkomende modificaties, die uitvoerbaar zijn met behulp van genbewerkingstechnieken of "gene editing"[14] . Om zeker te zijn dat de donorcellen voor de patiënt onschadelijk zijn en om GVH te vermijden, kan bijvoorbeeld een zogenaamde TCR-molecule (voor T-celreceptor) van het oppervlak van de cellen worden verwijderd. Om elke vorm van HVG te voorkomen, moeten de vreemde cellen bovendien ondetecteerbaar worden gemaakt voor het immuunsysteem van de patiënt. Hiervoor zijn verschillende strategieën mogelijk, waaronder het verlagen van het β2M-proteïnegehalte. Natuurlijk is het geen eenvoudige zaak om al deze modificaties aan te brengen, maar dankzij de inspanningen van tal van wetenschappers kan dit vandaag al.
Het concurrentielandschap en uitzicht op een jaareinde vol innovaties
Ondanks al deze nieuwe uitdagingen worden wereldwijd gebruiksklare CAR-T-celbehandelingen ontwikkeld en wordt de groeiende belangstelling voor donortherapieën nu al zichtbaar in de statistieken van bedrijven in de koellogistiek, zoals Cryoport, een van de leiders in de logistiek voor temperatuurgevoelige stoffen, zoals uit levende cellen aangemaakte geneesmiddelen. In het eerste kwartaal van 2019 werd meer dan 30% van hun diensten verleend in het kader van klinische proeven voor allogene therapieën.
“Ondanks al deze nieuwe uitdagingen worden wereldwijd gebruiksklare CAR-T-celbehandelingen ontwikkeld.”
De eerste, door Cellectis uitgevoerde klinische proef voor dit type behandeling voor terugkerende/refractaire acute lymfomatische leukemie heeft veeleer gemengde resultaten opgeleverd. Ze waren weliswaar zeer bemoedigend, want de meerderheid van de patiënten reageerde positief op de therapie, maar twee patiënten overleden ten gevolge van therapeutische toxiciteit[15].
Het allogene CAR-T-celtherapieprogramma van Cellectis en de portefeuille aan preklinische celtherapeutische middelen van Pfizer worden ontwikkeld door Allogene in samenwerking met Servier. Allogene werd gesticht door twee voormalige kaderleden van Kite Pharma die Gilead achter zich hadden gelaten. Volgend jaar zal het bedrijf naar verwachting verslag uitbrengen van de initiële resultaten voor de behandeling van acute lymfatische leukemie. De klinische proef op terugkerend/refractair non-Hodgkin-lymfoom werd pas aangevat. Cellectis hielp ook bij de ontwikkeling van drie andere kandidaat-producten voor de behandeling met allogene CAR-T-cellen in de klinische proeffase: elk product mikt met een specifiek tumorantigeen op verschillende soorten kanker. Een belangrijke gegevensupdate wordt verwacht tegen het einde van het jaar. Bovendien heeft Celyad in november 2018 de injectie van zijn therapeutisch product alloSHRINK CYAD-101 bij een eerste patiënt aangekondigd voor de behandeling van inoperabele gemetastaseerde colorectale kanker. CYAD-101 is ontstaan uit een vroegere samenwerking tussen Celyad en het Japanse ONO Pharmaceutical, dat momenteel met Fate Therapeutics samenwerkt aan de ontwikkeling van twee nieuwe, gebruiksklare celtherapieën. Het preklinische project van Fate verschilt aanzienlijk van alle andere CAR-T-celbehandelingen in die zin dat het gebruikmaakt van geïnduceerde pluripotente stamcellen in plaats van donorcellen. Verder is het allogene kandidaat-geneesmiddel van Precision Biosciences voor de behandeling van terugkerend/refractair non-Hodgkin-lymfoom en acute lymfatische leukemie type B in april de klinische fase ingegaan. De eerste resultaten worden tegen eind 2019 of begin 2020 verwacht. CRISP Therapeutics AG, een genoombewerkend of "gene editing"-bedrijf, vat dit jaar klinische proeven aan in het kader van zijn CTX110 CD19 allo-CAR-T-programma. Zijn concurrent, Editas Medicine, werkt ook aan de ontwikkeling van allogene celbehandelingen voor kankerbestrijding, en Gilead heeft een samenwerking met Sangamo opgezet voor de ontwikkeling van KITE-037, dat in 2020 de klinische fase zal ingaan. Tot slot heeft ATARA Biosciences, dat momenteel onderzoek doet naar allogene T-celimmunotherapie gericht tegen virale infecties en kankers ten gevolge van virale infecties, vier CAR-T-projecten gelanceerd in het kader van zijn preklinische pijplijn.
“Het aantal innovaties in immunotherapie neemt voortdurend toe naarmate meer en meer medische bedrijven zich engageren in de strijd tegen kanker.”
Het aantal innovaties in immunotherapie neemt voortdurend toe naarmate meer en meer medische bedrijven zich engageren in de strijd tegen kanker. Momenteel tellen een 140-tal bedrijven wereldwijd minstens één therapeutisch programma op basis van CAR-T-cellen[16] . Ook werkt een aantal bedrijven specifiek aan gebruiksklare CAR-T-cellen in laboratoria en in klinische proeven. Candriam koestert de ambitie om de meest veelbelovende ontwikkelingen te ondersteunen. We houden deze sector nauwlettend in de gaten en volgen de technologische vooruitgang op de voet. Deze doorgedreven analyse houdt met name een strikte evaluatie in van innovatieve technologieën en de afleiding van het potentiële effect op de aandelenkoers van de ondernemingen die ze ontwikkelen. De beleggingsstrategie van Candriam voor Oncologie is gericht op het ondersteunen van de meest dynamische bedrijven.
[1] https://www.nature.com/subjects/cytotoxic-t-cells
[2] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC298636/
[3] http://embomolmed.embopress.org/content/early/2017/07/31/emmm.201607485.long#DC4
[4] https://www.ncbi.nlm.nih.gov/pubmed/25317870?dopt=Abstract
[5] https://clinicaltrials.gov
[6] https://celltrials.org/public-cells-data/all-car-t-trials-cumulative-through-end-2017/56
[7] https://www.novartis.com/news/media-releases/kymriahr-tisagenlecleucel-first-class-car-t-therapy-from-novartis-receives-second-fda-approval-treat-appropriate-rr-patients-large-b-cell-lymphoma
[8] https://www.biopharmadive.com/news/car-t-supply-chain-cell-therapy-challenges-pharma/521560/
[9] https://www.yescarta.com/files/yescarta-pi.pdf
[10] https://www.europeancancerleagues.org/wp-content/uploads/2018/06/CAR-T-ECL-Article_Final_20062018.pdf
[11] https://cancerworld.net/cutting-edge/the-car-t-cell-revolution-what-does-it-offer-and-can-we-afford-it/
[12] https://www.evaluate.com/vantage/articles/news/corporate-strategy/novartis-hopes-kymriah-acceleration-can-save-its-car
[13] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5088751/
[14] https://www.ncbi.nlm.nih.gov/pubmed/30735463
[15] https://servier.com/wp-content/uploads/2018/12/PR_Servier-Allogene_ASH2018.pdf
[16] Opleiding onder de titel "Driving CARs in Aggressive Lymphoma" (Hoe CAR-T celtherapie voor agressief lymfoom stimuleren) op de jaarvergadering 2019 van ASCO, van 31 mei tot 4 juni 2019
